Journal club 2021
・Laporte et al. (2018)Mitochondria reorganization upon proliferation arrest predicts individual yeast cell fate. eLife, 7: e35685.
非増殖状態の細胞集団において休眠細胞と老化細胞を識別するのは非常に困難であり、これまではrefeed後の増殖を検証することでしか判別できなかった。著者らは、グルコース枯渇による増殖停止時に再編成されるミトコンドリア形態を指標として、酵母を静止細胞、老化細胞、死細胞に区別できることを明らかにした。実際に、YPDで培養7日目の細胞において小胞状ミトコンドリアを持つ細胞の多くは再増殖が可能な静止細胞であるのに対し、球状ミトコンドリアを持つ細胞の多くは呼吸機能に欠陥が生じ老化していることが示唆された。また、これらの指標に基づき、以前報告された静止細胞の特徴について再検討したところ、静止細胞の増殖能力は細胞体積、細胞密度、複製年齢に影響を受けないことが明らかにされた。(紹介者:掘江)
・Feder et al. (2020) Subcellular localization of the J-protein Sis1regulates the heat shock response. J. Cell Biol., doi: 10.1083/jcb.202005165
細胞ストレスに応答して転写を活性化するHsf1は、Hsp70が直接結合することにより、その活性が抑制されていることが知られている。著者らは、J-proteinであるSis1が、非ストレス下でHsf1-Hsp70複合体の相互作用を促進することでHsf1活性を抑制し、ヒートショックレスポンス(HSR)に関与していることを明らかにした。また、ヒートショックストレス下のSis1は、Hsf1抑制から離れて核小体と細胞質に局在し、小胞体周辺でプロテアソームやERAD関連タンパク質とネットワークを形成している可能性を報告している。これらの結果から、Sis1がHSRにおいて様々なプロテオスタシス機構を結び付ける役割をもつことが示唆された。今後、Sis1の核小体への局在化についても詳細が明らかになり、細胞内のプロテオスタシス機構のさらなる理解が進むことが期待される。(紹介者 今井F)
・Ghulam et al. (2019) Differential expression of duplicated ribosomal protein genes modifies ribosome composition in response to stress. Nucleic Acids Research, Vol.48, No.4. doi:10.1093/nar/gkz1183
酵母のリボソームタンパク質をコードしている遺伝子の大半は重複していることが知られているが、重複リボソームタンパク質遺伝子(dRPGs)のリボソーム合成への寄与は明らかになっていない。著者らはdRPGsのうちパラログ間で合成されるタンパク質が異なるものに着目し、非ストレス条件下ではどちらか一方のパラログが優先的に発現し、翻訳を行なうリボソームを構成していることを明らかにした。このようなパラログ間のタンパク質合成の違いは、主にスプライシングや3’ UTRの構造 (転写後修飾)と最適なコザック配列の有無 (翻訳効率)に依存していることが示唆された。またストレス条件下では、非ストレス条件下で優先的に発現していたパラログの翻訳が抑制され、もう一方のパラログを含んだリボソームが増加する傾向が見られた。ただしストレスの種類によって発現変化が見られるdRPGsが異なり、この例に沿わないdRPGsも見られたことから、ストレスに応答したdRPGsの発現変化および翻訳を行なうリボソームの構成変化は、ストレス特異的かつ各dRPGsのパラログ特異的に多段階で行なわれることが示唆された。(紹介者:安東)
・Liu et al. (2021) OXPHOS deficiency activates global adaptation pathways to maintain mitochondrial membrane potential. EMBO Rep., 22:e51606.
ミトコンドリアの膜電位は、ATP合成の他にも鉄硫黄クラスター(ISC)合成に必須であることが知られている。本研究は、電子伝達系の複合体Ⅲ、Ⅳ、Ⅴ、およびmtDNAを欠損させたOXPHOS(酸化的リン酸化)変異体が、どのように膜電位を維持するのかを明らかにした。これらの変異体は、1)ATPase活性阻害タンパク質Inh1(F1F0-ATP synthase のF1サブユニットに結合し、ATPの加水分解を阻害)とOXPHOSサブユニット(Cox4、Qcr2、Atp2など)のダウンレギュレーション、2)mRNA結合タンパク質Puf3を介した、ミトコンドリアインポートレセプターMia40のアップレギュレーション、3)Snf1/AMPKを介した解糖系のアップレギュレーションとリボソーム生合成のダウンレギュレーション、4)細胞質シャペロンのアップレギュレーション、といったストレス応答を活性化させ、膜電位を維持していることが明らかになった。本研究結果は、ミトコンドリア適応応答の新たな知見をもたらし、ヒトのミトコンドリア疾患の理解の助けとなるだろう。(紹介者:西野)
・Yoo et al. 2021. Chaperones Directly and Efficiently Disperse Stress-Triggered Biomolecular Condensates. Cell, doi: 10.1101/2021.05.13.444070
ポリA結合タンパク質であるPab1はストレスによってストレスグラニュール(SGs)に蓄積することが知られており、SGsのマーカーとして用いられている(Hoyle et al., 2007; Buchan et al., 2008)。本論文で筆者らは、in vitroにおいて酵母細胞に熱ストレスを与えることで形成されるPab1のcondensatesが、分子シャペロンによって消失させられることを明らかにした。また、この消失はミスフォールドタンパク質のモデルとして用いられるホタルルシフェラーゼの凝集体の脱凝集とは、速度、関与するシャペロン、脱凝集の程度、の3つの点で異なることを明らかにした。本研究はPab1のcondensatesが分子シャペロンの内因性の基質であるということ、および、消失におけるルシフェラーゼとの違いを明確にしたという点で重要である。一方、Pab1それ自体が分子シャペロンの内因性の「モデル」基質となるかについては疑問が残る。今後、分子シャペロンのモデル基質となる内因性タンパク質の探索が進むことが期待される。(紹介者:古谷)
・Gupta et al. (2018) The yeast stress inducible Ssa Hsp70 reduces α-synuclein toxicity by promoting its degradation through autophagy. PLoS Genet. 2018, 14:e1007751. doi: 10.1371/journal.pgen.1007751.
α-synucleinは凝集することで細胞毒性を示し、パーキンソン病などの神経変性疾患の原因となるとして知られている。著者らは、出芽酵母において、α-synによる細胞毒性がストレス条件下で誘導されるSsa Hsp70によって低減されることを明らかにした。同様の毒性低減の傾向がpolyQでも見られたことから、ストレス誘導性Hsp70はアミロイド形成タンパク質に特異的に作用していることが示唆される。また、Hsp70をコードするSSA1-4のうちSSA3だけを発現させた株では、α-synの過剰発現によりautophagyが誘導され、α-syn凝集体が分解されていた。この研究結果は、autophagyにおいてストレス誘導性Hsp70が関与していることを示唆するものであり、今後、さらなる研究が進むことが期待される。(紹介者 今井F)
・Edskes et al. (2021) Proteasome Control of [URE3] Prion Propagation by Degradation of Anti-Prion Proteins Cur1 and Btn2 in Saccharomyces cerevisiae. Genetics. 2021 May 17;218(1):iyab037. doi: 10.1093/genetics/iyab037.
[URE3]はUre2タンパク質のプリオンである。[URE3]はアンチプリオン因子であるBtn2やCur1によってcureされることが知られていた。Btn2はアミロイドを細胞内の一ヵ所に集めることで作用する。本論文では、プロテアソームの活性を低下させる変異が、Btn2やCur1を介して[URE3]をcureすることを明らかにした。プロテアソームの活性を低下させる変異が存在すると、Btn2やCur1のレベルが上昇することがウエスタンブロット解析やSILAC解析によって明らかになった。その結果、[URE3]プリオンは不安定化しcureされる。著者らは他にも、プロテアソーム阻害剤MG132処理によって[URE3]が不安定化されることや、別の酵母プリオン[PSI+]はプロテアソームに影響を与える変異によっては不安定化しないことを報告している。本論文の研究結果は、プロテアソームによるBtn2の分解を介した[URE3]の制御を示唆するものである。(紹介者:西野)
・Aryanpur et al.(2019) The DEAD-box RNA helicase Ded1 has a role in the translational response to TORC1 inhibition. Molecular Biology of the Cell http://www .molbiolcell.org/cgi/doi/10.1091/mbc.E18-11-0702
本論文は、開始前複合体(PIC)の形成を促すスキャニング因子Ded1が、通常時とは反対にストレス下では翻訳抑制に寄与するという内容である。著者らは、Ded1のC末端欠損変異体ではTORC1の阻害によって誘導される成長阻害と翻訳抑制が軽減されることを見出した。さらに、それはC末端におけるeIF4G1とDed1の結合が阻害されるために起こることも明らかにした。著者らは、ストレス時のDed1の機能として、開始前複合体(PIC)の形成を阻害し、Ded1の酵素活性を用いてPICからeIF4G1を取り除き、eIF4G1と共にDed1が分解されることで翻訳抑制を誘導しているのではないか、とする一つのモデルを提唱した。Ded1の機能が細胞の状態に応じて変化することは、ストレスによって誘導される翻訳抑制機構の解明に重要であると考えられる。(紹介者 安東)
・Ho et al. (2017) Deubiquitinating enzymes Ubp2 and Ubp15 regulate endocytosis by limiting ubiquitination and degradation of ARTs. Mol Biol Cell. 2017 May 1;28(9):1271-1283. doi: 10.1091/mbc.E17-01-0008. Epub 2017 Mar 15.
細胞膜表面のタンパク質のエンドサイトーシスによる発現低下は様々な環境刺激に適応し、生存するための基本的な細胞応答である。E3 ubiquitin ligase Rsp5-arrestin-related trafficking adaptor(ART) 複合体は細胞膜タンパク質の発現量制御に重要な役割を果たしており、ART-Rsp5複合体による細胞膜タンパク質のユビキチン化を介して、発現レベルを低下させるシグナルが伝導される。本論文で著者らは、ARTsが脱ユビキチン化酵素(DUBs)であるUbp2とUbp15によって脱ユビキチン化されることで、ARTsのhyper-ubiquitinationやプロテアソーム分解を阻害していることを報告した。また、Ubp2とUbp15によるArt4の安定化が、高濃度グルコースストレス下でのHxt6のエンドサイトーシスに重要であることが示された。これらの結果は、エンドサイトーシス経路におけるDUBsの新たな機能を明らかにするものである。また昨今、DUBsが細胞質のタンパク質品質管理にも関与することが示唆されており、今後新たな発見に繋がることが期待される。(紹介者 清水)
・Chernova et al.(2017) Yeast Short-Lived Actin-Associated Protein Forms a Metastable Prion in Response to Thermal Stress. Cell Rep. 2017 Jan 17;18(3):751-761. doi: 10.1016/j.celrep.2016.12.082
アミロイド形成と特定の環境因子が関与していることが知られていたが、詳しい分子メカニズムは不明だった。本論文では、熱ショックストレスによってアミロイド形成(プリオンの誘導)が引き起こされることを報告している。著者らは酵母プリオンタンパク質のひとつ、Lsb2を用いて実験を行なった。Lsb2は、アクチン結合タンパク質で、プリオンを形成することが明らかになっている。その結果、Lsb2は熱ショックストレスに応答して過剰生産され、[LSB+]というプリオン状態に変化することが明らかになった。さらに、[LSB+]を介して、酵母プリオンタンパク質Sup35のプリオン状態、[PSI+]が誘導されることも明らかになった。また、著者らはLsb2のプリオン化に、ユビキチン化や細胞骨格との相互作用が関与していることも報告している。本論文の研究結果は、パーキンソン病やアルツハイマー病といったヒトのアミロイドーシスと環境因子との関係を理解する助けとなると考えられる。(紹介者:西野)
・Work et al. (2020) Adaptability of the ubiquitin-proteasome system to proteolytic and folding stressors. Cell Biol. 2021 Mar 1;220(3):e201912041. doi: 10.1083/jcb.201912041.
本研究では細胞がFolding stressとProteolytic stressに対して異なる経路でPSR (Proteasome Stress Response)を誘導し、UPS (Ubiquitin Proteasome System)の機能を維持している事を明らかにしている。UPSとはユビキチン化を介してプロテアソームで標的タンパク質を分解するシステムの事で、細胞周期やシグナル伝達、タンパク質品質管理など様々な機能を制御している。そのため、UPSの機能を正常に保つ事は細胞にとって非常に重要な意味を持つ。UPSの機能が低下した場合はRpn4という転写因子がプロテアソーム構成因子の発現を促進する事でその機能を補っていると考えられている。Rpn4自身の発現量は,ストレス応答性の転写因子(Hsf1,Pdr1/3,Yap1など)によって活性化され、プロテアソームによる負のフィードバックを受ける事で、UPSの機能は一定に保たれている。こうしたストレス応答機構はPSRと呼ばれ、プロテアソームの活性を制御する上で、重要な役割を持つ。著者らはプロテアソームの機能が阻害されるProteolytic stress下ではRPN4の転写を介さず、既存のRpn4が安定化される事によってPSRが活性化されている事を明らかにした。一方でタンパク質変性を引き起こすFolding stress下では、生じた変性タンパク質が凝集体を形成し、Hsf1が活性化される事で、Rpn4の転写を促進し、PSRを活性化していることを見出した。本研究はProteolytic stressとFolding stressに対する適応メカニズムの違いを明らかにしたものであり、ストレス下のプロテアソームに関する非常に重要な知見をもたらすものである。(紹介者 吉田)
・Gallina et al. (2015) Cmr1/WDR76 defines a nuclear genotoxic stress body linking genome integrity and protein quality control. Nat Commun. 30;6:6533. doi: 10.1038/ncomms7533
DNA複製関連タンパク質のCmr1は、平常時は染色体に結合して存在しているが、細胞に複製ストレスがかかると凝集体形成酵素のHsp42やBtn2によって、核内の変性タンパク質deposition siteであるINQ (intranuclear quality control compartment)に再局在される。著者らは、Cmr1がINQでDNA損傷チェックポイントやシャペロニン関連のタンパク質と共局在することを明らかにした。これより、INQによって細胞周期などの生物学的プロセスが制御されていることが示唆された。さらに、SUMO化タンパク質やリン酸化タンパク質の分解やリフォールディングにCmr1が関与している可能性も考えられる。今後、INQを通じたタンパク質のターンオーバーや再局在のメカニズムについて、さらなる研究が進むことが期待される。(紹介者 今井F)
・Iserman et al. (2020) Condensation of Ded1p Promotes a Translational Switch from Housekeeping to Stress Protein Production. Cell 181, 818–831.
doi.org/10.1016/j.cell.2020.04.009
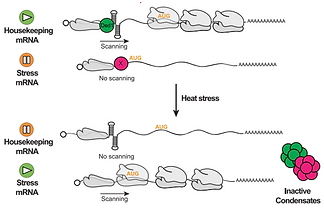
細胞は、温度上昇を感知して熱ショック応答機構を誘導するが、そのメカニズムに関しては不明な点が多い。著者らは、翻訳レベルで発現量が変化した遺伝子のmRNAの5’ UTR構造の複雑さに着目し、熱ショックストレス下において、長鎖で多くの二次構造を含んだ5’ UTRを持つmRNA(ハウスキーピング転写産物)から短鎖で二次構造が少ない5’ UTRを持つmRNA(ヒートショック転写産物)へ翻訳の切り替えが起こっていることを明らかにした。また、スキャニング因子Ded1が長鎖で多くの二次構造を含んだmRNAとともに相分離し、凝集体を形成して不活性化することで、翻訳の切り替えが行われることも明らかにしている。これは自然界に広く存在し、ストレス防御タンパク質の優先的な翻訳を実現する熱ショック応答プロセスの重要な一部ではないかと考えられた。(紹介者 安東)
・Sethi et al., (2018) Discrete roles of trehalose and Hsp104 in inhibition of protein aggregation in yeast cells. FEMS Yeast Res., 18(6): foy058. doi: 10.1093/femsyr/foy058
酵母においてHsp104とトレハロースはともにタンパク質凝集を制御しているがそれぞれの役割は不明確である。著者らは形質転換によって変異型ハンチンチンタンパク質(103Q-htt)を合成するようになった酵母とHsp104の活性を低下させるグアニジン塩酸塩(GdHCl)を用いて実験を行なった。103Q-httはヒトのハンチントン病の原因となっているタンパク質の一種で、正常なタンパク質Httと比べてポリグルタミンが異常に伸長することで凝集・不溶化し 線維状になって細胞に蓄積する。著者らは103Q-httを野生株で発現させ、そこから3時間までの初期段階にHsp104を阻害することによって103Q-httの凝集形成が抑制される一方、それ以降にHsp104を阻害しても凝集形成が抑制されないことを明らかにした。また、トレハロースの添加により活性が低下したHsp104のATPase活性が回復すること、細胞内のトレハロースの有無が103Q-httの可溶化に影響を与えることも報告している。タンパク質が異常な構造をとるプリオンについても、本論文で述べられた103Q-httと同様にHsp104の抑制が凝集の抑制を引き起こすという報告もなされている。(* Singh et al., 2013)本論文をはじめとするトレハロースとの関わりを含めたHsp104に関する研究は、プリオンや103Q-httといったタンパク質のミスフォールディングによっておこる病気についてだけでなく、ストレスによって生じる凝集タンパク質の分解・再生機構におけるHsp104の役割を理解する上でも意義があると考えられる。(紹介者 古谷)
(* Singh et al., Hsp104 as a key modulator of prion-mediated oxidative stress in Saccharomyces cerevisiae. Biochem. J., 2013;454:217–225. DOI: 10.1042/BJ20121806)
・Samant et al. (2018) Distinct proteostasis circuits cooperate in nuclear and cytoplasmic protein quality control. Nature, 563(7731):407–411. doi:10.1038/s41586-018-0678-x. Epub 2018 Oct 31.
細胞はProtein Quality Control(PQC)能力を発達させ、変性タンパク質の毒性に対処しているが、その具体的なメカニズムについては未解明な点が多く残されている。本論文は、変性タンパク質が核内と細胞質で異なる経路によって分解される事を報告している。具体的には、核内ではK48ユビキチン鎖修飾(Hsp70の制御のもとE3 ligase San1によって行われる)を、細胞質ではK48ユビキチン鎖(Hsp70の制御のもとYdj1, Sti1, Hsp90, Sse1, Ubr1依存的に行われる)とK11ユビキチン鎖(Hsp70の制御のもと、Sis1, Hrd1, Dao10依存的に行われる)の両方による修飾を受けて、プロテアソームで分解されるという事を明らかにしている。 核膜によって隔たれた核と細胞質では、変性タンパク質の危険性や、プロテアソームの濃度が異なるため、異なるユビキチンシグナルを使い分ける事で、環境に適した処理効率に調整しているのではないかと考察されている。本研究で得られた知見は、酵母のみならずヒトのタンパク質変性を伴う疾患について理解する上でも重要だと考えられる。(紹介者 吉田)
・Klaips et al. (2020) Sis1 potentiates the stress response to protein aggregation and elevated temperature. Nat Commun., 11(1):6271. doi: 10.1038/s41467-020-20000-x.
ハンチントン病やパーキンソン病は、アミロイドを形成することが原因で発症する。アミロイドの蓄積は、老化に伴う細胞のプロテオスタシス能力の低下によって促進される可能性が挙げられている。著者らは、ポリグルタミン(ポリQ)タンパク質凝集モデルを用いて、Hsp40のコシャペロンであるSis1がタンパク質毒性ストレスの重要なセンサーであることを明らかにした。Sis1は、可溶性のポリQオリゴマーを浸透性のある凝縮物へと変化させた。さらに、Hsf1に結合していたHsp70(Ssa1/2)がこのポリQ凝縮物中に液体のような状態で蓄積することによって、Hsf1を介したストレス応答が活性化された。Sis1は、定常レベルを低くすることでストレス応答の大きさを制御し、環境変化に過敏に反応することを回避するための制御因子として機能している。 (紹介者 今井S)
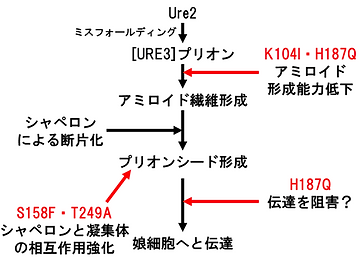
・Kumar et al. (2020) Mutations Outside the Ure2 amyloid-Forming Region Disrupt [URE3] Prion Propagation and alter Interactions with Protein Quality control Factors Mol Cell Biol. 2020 Oct 13;40(21):e00294-20 https://doi.org/10.1128/MCB.00294-20
プリオンとは感染性のタンパク質因子である。出芽酵母においてもプリオン化するタンパク質が知られており、酵母プリオンと呼ばれている。例えば、窒素異化抑制に関与する転写調節因子Ure2がミスフォールディングすることで、プリオン型の[URE3]となることが知られている。本論文では、[URE3]プリオンを阻害する点変異が同定された。これらの変異はプリオンの形成能力に直接関与するアミロイド形成領域外にある変異であり、様々な方法で[URE3]プリオンを阻害する。これらの変異は、アミロイド形成能力を阻害したり(K104I、H187Q)、タンパク質品質管理(PQC)因子であるBtn2、Cur1やHsp42との相互関係を強めたりする(S158F、T249A)作用を持つことが明らかになった。これらの作用が働く結果、点変異は[URE3]プリオンを阻害する。
今回の発見は、アミロイド形成領域外の領域がアミロイド繊維の形成や不安定化に関与している可能性を示す。分子レベルでのプリオン阻害のメカニズムへの理解が、今後さらに進んでいくことが期待される。(発表者:西野)
・Żwirowski et al. (2017) Hsp70 displaces small heat shock proteins from aggregates to initiate protein refolding. EMBO J. 15;36(6):783-796. doi:10.15252/embj.201593378.
Small heat shock proteins(sHsps)は進化的に保存された、タンパク質毒性に対して細胞を保護するATP非依存的シャペロンである。sHspsは凝集化傾向のあるミスフォールドタンパク質と複合体を形成し、ATP依存的Hsp70-Hsp100シャペロンシステムによる基質タンパク質の可溶化やリフォールディングを促進させる。著者らは、基質タンパク質の可溶化やリフォールディングの初期段階において、Hsp70とsHspsが相互作用していることを明らかにした。大腸菌の分子シャペロンを用いたin vitroの実験では、Hsp70がsHsps-基質複合体の表面上にあるsHspsと置き換わり、複合体と結合することでよりタイトな凝集体形成を防ぎ、基質タンパク質をリフォールディング経路に誘導することが示唆された。また、Hsp70とsHspsの置換はHsp70濃度変化に大きく依存している。以上の結果から、sHsps/Hsp70の相互作用が、リフォールディングに適した条件を示す細胞内Hsp70 availabilityに沿って基質リリースを促進させることで、タンパク質恒常性に大きな役割を示していることが示唆された。In vivoの実験においても、Hsp70によるsHsps-基質複合体からのsHspsのリリースが観察された。酵母の生体内でのリフォールディング経路においてもsHsps/Hsp70の相互作用が関与しているのか、今後の研究が期待される。(紹介者 清水)
・Mathew et al. (2020) Cdc48 regulates intranuclear quality control sequestration of the Hsh155 splicing factor in budding yeast. J. Cell Sci. 133. https://doi.org/10.1242/jcs.252551
真核生物のCdc48はAAA型分子シャペロンであり、細胞内不要タンパク質の分解に重要な役割を担っている。本論文では、酵母のCdc48がMMSによるストレス下で核内変性タンパク質堆積場(INQ)に局在化し、INQに蓄積したスプライシング因子Hsh155の分解に関わることを報告している。さらに著者らは、通常時もCdc48がHsh155と物理的に相互作用しており、それによりスプライソソーム複合体SF3B 内でのHsh155の安定性を保っていることを明らかにした。MMSによるDNA損傷やcdc48変異株では、Hsh155の局在やターンオーバーが変化し、スプライシングの抑制が起こる。これらのことから、Cdc48はこれまで報告されてきた不要タンパク質の分解だけでなく、スプライソソーム複合体の安定性にも影響を及ぼして、タンパク質の品質管理(PQC)に関与していることが示唆された。今後、ストレス下での遺伝子発現制御におけるCdc48やINQの役割について、さらに理解が進むことが期待される。(紹介者:今井F)
・Bresson et al. (2020) Stress-Induced Translation Inhibition through Rapid Displacement of Scanning Initiation Factors. Molecular Cell 80, 470–484. https://doi.org/10.1016/j.molcel. 2020. 09.021
酵母は環境変化によって被るストレスに応答するために、生体内で遺伝子発現の大幅な変化を誘導する。そのため、酵母のストレス応答にはしばしばRNA結合タンパク質が関与している。著者らは、生体内のRNA-タンパク質相互作用を網羅的に解析することにより、グルコース枯渇や熱ショックストレス下で、翻訳開始前複合体のスキャニングに関わる因子(eIF4A, eIF4B, Ded1)とmRNAの結合が減少することを明らかにした。このことはスキャニング阻害によって翻訳抑制が誘導されることを示唆している。また、著者らは、熱ショックストレスによる翻訳抑制の結果として、リボソームがmRNAから解離し、速やかなmRNA分解が起こっていることを明らかにした。(図参照)(紹介者:安東)
・Yasuda et al. (2020) Stress- and ubiquitylation-dependent phase separation of the proteasome. Nature 578, 296–300. https://doi.org/10.1038/s41586-020-1982-9
近年、ストレス顆粒や核内小体、オートファゴソームなどの生体分子の液-液相分離によって生じる凝縮物や非膜性細胞内小器官の制御にユビキチン関連分子が関係していることが発見された。しかし、プロテアソームがその制御に関連しているかは不明であった。著者らはスクロースを用いた高浸透圧ストレスによってプロテアソームを含む液滴が核内で形成されることを明らかにした。また、著者らはこの液滴の形成にはプロテアソームの基質シャトリングタンパク質であるRAD23Bや4分子以上のユビキチンから成るユビキチン鎖が必要であることを明らかにした。これらの結果はユビキチン鎖依存的に起きる液-液相分離がプロテアソームによる分解を促進する区画の形成を誘導することを示唆している。(図参照)(紹介者:古谷)