Journal club 2020
・Kandasamy and Andréasson. Hsp70-Hsp110 chaperones deliver ubiquitin-dependent and -independent substrates to the 26S proteasome for proteolysis in yeast. J Cell Sci. 2018 Mar 20;131(6):jcs210948.doi: 10.1242/jcs.210948.
タンパク質のquality controlでは、変性タンパク質が分子シャペロンによって認識され、ユビキチンリガーゼによってユビキチン化されたのち26Sプロテアソームで分解されるユビキチン-プロテアソームシステム(UPS)が重要な役割を担っている。Hsp70シャペロンとHsp110 (Hsp70 nucleotide exchange factor)ファミリータンパク質がUPSに関与することは知られていたが、詳しいメカニズムは解明されていなかった。著者らは、Hsp70と結合したユビキチン化変性タンパク質だけでなくユビキチン化されない変性タンパク質の分解にも、Hsp110タンパク質(出芽酵母の場合Sse1とSse2)が必要であることを明らかにした。Hsp110は26Sプロテアソームの19S regulatory particleに結合し、Hsp70 (ADP結合型)と結合した変性タンパク質をプロテアソームへとリクルートすることによって、変性タンパク質の分解を促進している(図参照)。(紹介者:清水)
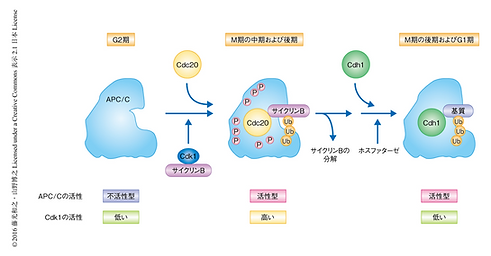
Monica.C et al. Sequential E2s Drive Polyubiquitin Chain Assembly on APC Targets Cell, p127-139, JULY 13, 2007
タンパク質を分解するシステムの一つとしてユビキチンープロテアソーム系が挙げられる。その中でユビキチン結合酵素(E2)に結合したユビキチンを標的タンパク質に転移させるユビキチンリガーゼ(E3)として、有糸分裂のM期に関係するタンパク質の分解を行う後期促進複合体(APC)が存在する。サイクリン依存性キナーゼ(Cdk1)とサイクリンBが結合することでM期の開始を指示し、APC活性化タンパク質であるCdc20とCdh1がそれぞれ有糸分裂中期と後期にAPCを活性化させる。活性化されたAPCがサイクリンBを分解することでM期の終了の合図となる。また、セパレースのコヒーシンを切断する働きを阻害するセキュリンの分解をAPCが誘導することによって、分裂後期へと移行する。今回の研究では、E2の中でUbc1とUbc4がAPC依存的にユビキチン化を行うことを示した。精製したこれら2つのE2と未修飾または既にユビキチン化されたセキュリンやサイクリンを用いた解析から、Ubc4はセキュリン・サイクリンの最初のモノユビキチン化を引き起こし、Ubc1はその後に続くポリユビキチン化を促進させることが示唆された。また、高等真核生物では、Ubc1のホモログであるE2-25KがUbc1と同様の働きをすることが示唆された。加えて、Ubc4の役割は、UbcH5とUbcH10が代替する可能性を提言している。本論文は、2つのE2(Ubc1とUbc4)がそれぞれの役割分担をしながら連携して機能することを初めて明らかにした報告である。(紹介者 今井)
・Ibarra et al. The San1 Ubiquitin Ligase Functions Preferentially with Ubiquitin-conjugating Enzyme Ubc1 during Protein Quality Control J.Biol.Chem., 2016,36,18778-18790
タンパク質品質管理(PQC)は、タンパク質の恒常性(proteostasis)を維持するために重要である。誤って折りたたまれた、または損傷を受けたタンパク質(変性タンパク質)の除去は、主にユビキチンープロテアソーム系(UPS)で行われ、ユビキチン結合酵素(E2)とユビキチンリガーゼ(E3)がポリユビキチン鎖の標的となるタンパク質基質にユビキチンを付加することで分解シグナルを伝達する。San1は、核内のPQCを制御するE3であり、遺伝学的解析からポリユビキチン鎖を形成するためにE2のCdc34とUbc1を核内でリクルートすることが明らかにされている(Gardner et al, (2005) Degradation mediated protein quality control in the nucleus. Cell.)。また、先行研究から1つのE3と異なる2つのE2が協調して働く場合と1つのE3がそれぞれのE2で個々に働く2つの可能性が報告されている(Christensen et al. (2007) E2-BRCA1 RING interactions dictate synthesis of mono- or specific polyubiquitin chain linkages. Nat. Struct. Mol. Biol.)。そこで著者らは、San1とCdc34、Ubc1間での相互作用についてin vitroでの再構成実験を行った。ここでは、すべてのリジン残基をアルギニンに置換したKR San1、WT yCdc34、Cdc34がSCFに結合する際に重要なドメインであるacidic tailを欠損させたΔ190 yCdc34、WT Ubc1の4つを精製し、基質として放射性標識したSan1ペプチドを用いた。今回の実験結果から、San1はCdc34とUbc1のそれぞれでユビキチンを基質へと転移させたが、San1はUbc1と特に親和性が高く、ユビキチン化をUbc1と優先して行うことが示された。また、San1は、Ubc1が枯渇した場合にCdc34を代替として用いると推測された。今回のような速度論的解析をさらに進めていくことで、in vivoでのSan1とCdc34、Ubc1間の相互作用を明確にする手掛かりが得られるのではないかと考えられた。(紹介者 今井)
・Meiyan et al.Glycolytic Enzymes Coalesce in G Bodies Under Hypoxic Stress. Cell Rep
. 2017 Jul 25;20(4):895-908. doi: 10.1016/j.celrep.2017.06.082.
解糖は低酸素条件下や高いエネルギー需要のもとで増加するが、そのメカニズムは十分に解明されていない。著者らは出芽酵母において、低酸素状態が解糖系酵素(律速段階のホスホフルクトキナーゼのサブユニットであるPfk2pを含む)がGlycolytic bodyまたはG bodyと呼ばれる膜を持たない顆粒に凝集することを発見した。本論文では、著者らは低酸素条件で誘導されるG bodyのコンポーネントの解析や、その形成に必要な遺伝子の特定、G body形成の有無による炭素代謝の変化について研究を行った。G bodyのコンポーネントには解糖系酵素だけではなくタンパク質分解、脂肪酸合成などの代謝に関わるタンパク質も含まれていることが分かった。また、G body形成に必要なタンパク質を同定したところ、そのタンパク質(Ira2p,Sod1p,Ard1p)はG bodyに多くは局在していないことが分かった一方で、G bodyに多く局在するタンパク質はその形成にはほとんど関与していないことが明らかとなった。これらのことから、G body関連因子にはそのコアとして局在する、または一過的にその形成に関与するタンパク質が存在すると考えられる。炭素代謝については、G body形成細胞でグルコースの取り込み速度が上昇し、解糖系が活性化することが示唆された。また、哺乳類細胞のHepG2細胞でも低酸素状態で解糖系酵素の凝集体形成が見られることから、低酸素条件下でのG body形成は真核生物に保存されたメカニズムだと考えられた。G bodyを介した炭素代謝の制御機構が明らかになれば、低酸素条件での癌細胞の炭素代謝を理解する上での重要なヒントとなる可能性があり、今後の研究が期待される。(紹介者 清水)
・Miura et al. Spatial Reorganization of Saccharomyces cerevisiae Enolase To Alter Carbon Metabolism under Hypoxia. 2013 Aug;12(8):1106-19.doi: 10.1128/EC.00093-13. Epub 2013 Jun 7.
著者らは、出芽酵母においてenolase(Eno2p)を含む解糖系酵素が低酸素条件下で凝集体(G body)を形成することを発見し、その機能や制御機構について検証した。Eno2pのN末端領域はβ-ヘアピン構造をとっており、この領域はよく保存されている。まず著者らは、Eno2pのN末端領域の1-28残基のみで凝集体の形成が可能であることを明らかにした。この領域が凝集体形成の役割を持つか検証したところ、V22が低酸素条件下での凝集体形成に重要であることを明らかにした。凝集体形成のメカニズムを検証した結果、新規タンパク質合成・TORC1依存的制御・ミトコンドリア活性・SNF1/AMPK(AMP活性化プロテインキナーゼ)などの関与が示された。SNF1欠損株では30℃でG body形成が阻害されることからSNF1/AMPKの関与が示唆されたが、37℃ではG bodyが形成された。そのため、G-body形成には温度による制御と溶存酸素レベルによる制御があると考えられる。また低酸素状態では、G bodyを形成しない細胞よりもG bodyを形成する細胞でピルビン酸やオキサロ酢酸のレベルが上昇しており、G body形成を介して炭素代謝が調節される可能性が示唆された。(紹介者 清水)
(マゼンタ:低酸素条件 グレー:酸素圧正常条件)